LA REVOLUCIÓN CRISPR-cas


El estudio de ADN y microorganismos, ha traído muchas sorpresas. Una de ellas ha sido el descubrir cómo se protegen y como han podido sobrevivir las primeras células autónomas: Las procariotas, en esa guerra por la supervivencia que mantenemos todos los seres vivientes. La mayor amenaza para todos, son los virus, pues somos vulnerables a su ataque. Su simplicidad estructural (un genoma y una cápside que lo protege) le da la capacidad de reconocer e invadir a cualquier ser viviente. Sin embargo, al contrario de lo que se podría pensar, la mayor parte de los 〖10〗^31 virus que moran en la tierra, no atacan a organismos pluricelulares de gran tamaño, sino que se propagan de un microorganismo a otro y sus víctimas número uno son las células procariotas, es decir las bacterias y las arqueas, quienes a diferencia de las células eucariotas, no poseen núcleo y que son, después de los virus, la segunda entidad biológica más abundante de nuestro planeta , se encuentran en una cantidad de un 5-〖10〗^30
La invasión de una procariota por una partícula vírica le trae consecuencias nefastas, ya que normalmente le provoca la muerte. El virus se une a un componente de la envoltura celular de la procariota, seguida de la introducción del material genético al citoplasma. Utiliza los componentes de este para replicarse, generando nuevas partículas víricas, una vez hay cierta cantidad de virus, se liberan al provocar la lisis de célula y reinician su proceso en otras células. Las procariotas tuvieron que elaborar mecanismos de defensa, pues de lo contrario hubieran desaparecido como especie.
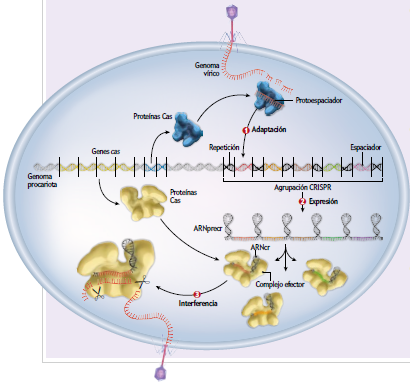
El descubrimiento de estos mecanismos se inició en los años 50 cuando en la U. de Illinois USA estaban estudiando la capacidad infectiva de un virus que atacaba la Escherichia Coli, pero se dieron cuenta que la vulnerabilidad de la infección dependía en gran medida de la cepa bacteriana a la que había infectado antes el virus. 10 años después en Ginebra descubrieron la causa, las bacterias tenían un mecanismo de defensa innato, llamado el sistema de restricción – modificación (R-M) con el cual podían reconocer el virus e inactivarlo, gracias a la endonucleasa, una enzima que corta y digiere el ADN vírico en cierta secuencia correspondiente a unos pocos pares de bases. Al mismo tiempo una enzima metilasa evita la degradación de esta secuencia en el ADN bacteriano al adicionarle un grupo metilo. Pero este sistema R-M es inespecífico y algunos virus en esta carrera armamentística han adquirido mecanismos que inactivan los sistemas R-M y uno de los más frecuentes es modificar su ADN. Por su parte las procariotas elaboraron un sistema más específico: El sistema CRISPR. Sus secuenciadores reconocen una secuencia especifica de un virus, elaboran un ARN que guía a una endonucleasa: la proteína cas, quien corta y degrada esta secuencia en el virus. El nombre CRISPR son las siglas en ingles de “Repeticiones palindrómicas cortas agrupadas y regularmente Interespaciadas”. Esta es la forma adquirida y HEREDABLE de inmunidad de las procariotas, ya que son, como una forma de vacunarse contra determinados virus, ya que estas partículas son integradas en varias partes a su ADN. Estas secuencias repetidas fueron identificadas en los años ochenta en la universidad de Osaka. Pero su función precisa apenas pudo ser esclarecida hace unos 10 años.

El descubrimiento de este sistema de inmunidad adquirida de las procariotas tiene una importancia biológica enorme, debido a las consecuencias directas sobre la supervivencia de estos microorganismos, lo cual, a su vez, repercute sobre los demás seres vivientes. La sencillez molecular del mecanismo de inmunidad CRISPR, permite su fácil manipulación en los hospederos naturales con diversos fines, tales como su reprogramación para dirigirlos contra elementos genéticos concretos. Un ejemplo de esto, fue la modificación de bacterias que se utilizan rutinariamente en la elaboración industrial de alimentos como yogures y quesos, haciéndolas resistentes a la infección por virus que con frecuencia las atacaban durante el proceso de producción. También se han trasferido sistemas CRISPR-cas a procariotas carentes de ellos, dotándolas de una inmunidad eficaz.
La ingeniería genética comenzó en los años setenta, cuando Paul Berg cortó un fragmento de ADN procedente de un virus que infecta a bacterias y lo unió al ADN de un virus de mono. En ese mismo período, Herbert W. Boyer y Stanley N. Cohen crearon organismos en los que habían introducido genes que se mantenían activos durante generaciones. Hacia finales de los setenta, la compañía de Boyer, Genentech, producía insulina a gran escala a partir de la bacteria Escherichia coli, la cual albergaba un gen sintético humano. Y en laboratorios de todo el mundo ya se usaban de manera rutinaria ratones transgénicos para estudiar enfermedades. Sin embargo, los métodos de aquella época presentaban dos grandes limitaciones: eran imprecisos y difíciles de aplicar a gran escala. El problema de la imprecisión se resolvió en los años noventa cuando se diseñaron unas proteínas que podían cortar el ADN en localizaciones específicas. Ello supuso un gran avance con respecto a las técnicas de inserción aleatoria de ADN que se usaban hasta entonces y que dependían de la suerte para generar una mutación útil. A pesar de este salto cualitativo, todavía se tenía que diseñar una proteína específica para cada secuencia de ADN que se deseara modificar, una tarea que resultaba lenta y complicada. Esa realidad cambió con el descubrimiento del sistema CRISPR-cas.
El campo que abrió esta modalidad es muy amplio, además de su empleo en bacterias, los componentes de los sistemas CRISPR-cas han dado lugar a la implementación de un arsenal de estrategias de biología molecular, capaces de actuar sobre material genético purificado (in vitro) o en el interior de células eucariotas, ya sean aisladas (cultivos) como en aquellas que forman parte de un organismo. Esta técnica permite modificar (eliminar, corregir, reemplazar, relocalizar) la información genética, controlar la expresión de los genes o detectar y visualizar regiones concretas de un genoma, todo ello con una facilidad, rapidez y precisión sin precedentes. El impulso a la investigación biológica en sus diversos campos es extraordinario, ya que facilitan la tarea de identificación de la función de elementos genéticos y su implicación en el desarrollo del organismo, la diferenciación celular, el envejecimiento, la vulnerabilidad a las infecciones o el origen y evolución de las enfermedades tanto en plantas como en animales, incluidos los humanos. El uso de estas técnicas está generando grandes expectativas para la prevención y tratamiento de enfermedades de diversa índole, que van desde la infección por virus hasta procesos cancerígenos o trastornos neurodegenerativos.
Ahora viene la parte mezquina. Desafortunadamente la ciencia ya no es solamente el esplendor de lo nuevo y la satisfacción de encontrar nuevos pilares en el conocimiento que nos permitan mejorar. Este sistema está en mora de recibir un premio nobel, por ser un paso gigantesco en el conocimiento de la vida y por las implicaciones en la mejoría de la misma, al ser una herramienta poderosa para encontrar el remedio a la mayoría de las enfermedades que nos afligen: Enfermedad cardiovascular, trastornos metabólicos, cáncer, infecciones, defectos congénitos. Sin embargo, existen una buena cantidad de investigadores y laboratorios que quieren atribuirse su descubrimiento, en países como USA, España, Japón, Suiza, Holanda. Y aunque los trabajos que produjeron, contribuyeron a encontrar y esclarecer el mecanismo CRISPR-cas no se le puede dar autoría definitiva a solo un grupo de ellos.
El otro aspecto es el ético. En diciembre de 2015 tuvo lugar la Cumbre Internacional sobre la Edición Genética en Humanos y fue organizada por las estadounidenses Academia Nacional de Ciencias y Academia Nacional de Medicina, la Sociedad Real de Londres y la Academia de las Ciencias China (En la reunión se pudo observar la fuerza con la que está emergiendo China en el campo de la genómica). En concreto, gran parte de la discusión tuvo lugar en torno a un trabajo aparecido en Protein Cell, en el que Puping Liang y sus colaboradores utilizaron la técnica de edición genética CRISPR-Cas9 para modificar un gen en embriones humanos no viables. Al final de la reunión el comité organizador escribió una declaración que establece que sería irresponsable realizar edición genética en células germinales —las que pueden transmitir su información genética a la descendencia, como óvulos y espermatozoides— hasta que los criterios de eficacia y seguridad de la técnica fueran resueltos y hasta que hubiera un consenso sobre lo apropiado de la aplicación propuesta. El documento termina señalando que hasta hoy estos criterios no existen para ninguna aplicación clínica. El asunto de lo ético de esta tecnología sigue pendiente.

La controversia se hizo de nuevo relevante en noviembre de 2018 cuando el investigador He Jiankui, profesor de la Universidad de Ciencia y Tecnología del Sur de China anunció en You Tube “Dos niñas chinas llamadas Lulu y Nana llegaron al mundo llorando tan sanas como cualquier otro bebé”. En el video el científico narraba que la gestación de las niñas se inició mediante un procedimiento de fecundación in vitro. He y su equipo obtuvieron esperma del padre, quien está infectado con el virus de inmunodeficiencia humana (VIH), y óvulos de la madre, que no está infectada. Los óvulos se fecundaron en el laboratorio. Por cada óvulo fecundado se formó un huevo, o cigoto, de una sola célula que inmediatamente después se duplicó en dos, cuatro, ocho… hasta formar un blastocisto, es decir, un embrión de cinco días, con aproximadamente 200 células. En el experimento de He, al momento de la fecundación, cuando se unieron el óvulo y el espermatozoide, se agregó una proteína con instrucciones para modificar la información genética del cigoto, tras lo cual dos de estos embriones modificados fueron implantados en el útero de la madre. Meses después nacieron Lulu y Nana. A principios de enero de 2019, las autoridades chinas iniciaron una investigación contra He Jiankui y fue acusado de manipular genéticamente a dos gemelas utilizando CRISPR, más un tercer bebé durante su embarazo. No solo eso, pues se concluyó que el investigador chino hizo todo lo posible por burlar las distintas regulaciones éticas, económicas y legales. Según informa la agencia oficial de noticias china Xinhua, He Jiankui fue condenado a tres años de cárcel y una multa de tres millones de yuanes, unos 384.000 euros.
Indudablemente esta técnica es un gran avance para el avance y manejo de muchas disciplinas, solo se puede confiar en que su práctica y desarrollo siga el camino más adecuado para beneficio de la humanidad.
